2026 年 1 月 8 日,河南大学基础医学院李晓静在国际权威期刊《Advanced Healthcare Materials》(IF=9.6,工程技术 / 生物医学工程领域二区 Top)在线发表了题为 “Molecular Engineering of Quinolinium Cyanine Nanoagonist for Metastasis-Suppressed NIR-II Photothermal Immunotherapy” 的文章。

三阴性乳腺癌(TNBC)作为恶性程度最高的乳腺癌亚型,因缺乏治疗靶点,常面临化疗疗效有限、易转移复发等临床困境。传统手术联合化疗存在切除不彻底、药物毒性大、难以抑制远处转移等问题。为此,开发能够同步实现肿瘤消融与转移抑制的新型治疗策略成为迫切需求,其中响应第二近红外区(NIR-II,1000-1700 nm)的有机光热试剂被视为重要突破口。
针对传统光热疗法(PTT)穿透深度不足、光热效率有限及免疫激活能力弱等问题,本研究通过分子工程策略,以4-甲基喹啉为核心骨架,经苄基给体-氰基受体功能化修饰,成功设计出新型NIR-II光热敏化剂BOQCyCN。其吸收峰红移至1022 nm,精准匹配NIR-II治疗窗口,可实现超过1 cm的深层组织穿透,从而突破近红外一区(NIR-I)穿透深度不足5 mm的限制。
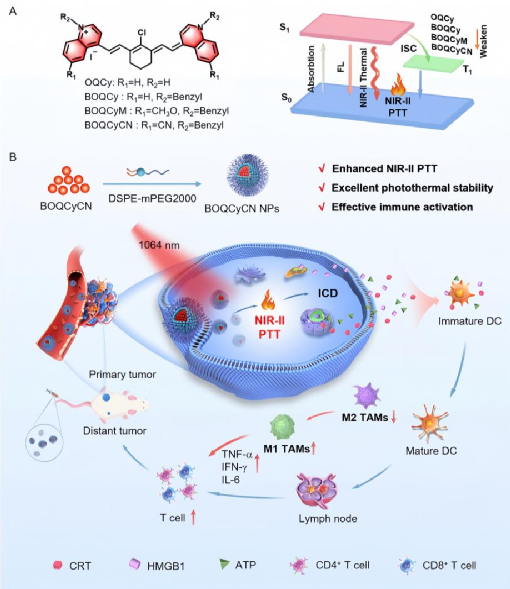
图 (A) NIR -II喹啉菁的开发。(B) BOQCyCN纳米颗粒用于双侧肿瘤光热免疫治疗示意图
经DSPE-mPEG2000共组装形成的BOQCyCN纳米颗粒(NPs)在动物模型中展现出“精准消融-免疫激活-抑制转移”三重协同疗效:首先,其光热转换效率达62.9%,在0.6 W cm⁻⟡的1064 nm激光照射下可有效消融肿瘤,实现95%的原发瘤体积缩减且无复发;其次,光热诱导免疫原性细胞死亡(ICD),释放钙网蛋白(CRT)、高迁移率族蛋白 B1(HMGB1)等信号,促进CD8⁺ T细胞(提升5.5倍)与CD4⁺ T细胞(提升2.3倍)浸润,并将肿瘤相关巨噬细胞由M2型重编程为M1型,M1/M2比值从0.33提高至2.55,逆转免疫抑制微环境;此外,激活的系统性免疫应答产生显著“远位效应”,对远端转移瘤抑制率达96%,优于NIR-I窗口照射组(62%)。
安全性方面,BOQCyCN NPs具有良好的肿瘤靶向性,静脉注射12小时后在瘤区富集最高,主要经肝脏代谢,未对心、肺、肾等主要脏器造成明显损伤,血液学及肝肾功能指标无异常,小鼠体重稳定,证实其良好生物相容性。
本研究的创新在于,通过分子结构精准调控,克服传统NIR-II有机光热剂的设计瓶颈,实现了吸收波长、光热效率及稳定性的协同提升,并构建了“局部光热消融-全身免疫激活”协同治疗新模式,推动三阴性乳腺癌治疗从局部消融向抑制转移与预防复发转变。该研究融合分子工程、纳米技术与免疫学等多学科手段,形成了从分子设计到临床前评估的完整链条,彰显跨学科策略在攻克恶性肿瘤中的关键价值。
责任通讯作者简介

李晓静,中共党员,博士,校聘副教授,基础医学院团委负责人,研究生导师。博士毕业于大连理工大学精细化工国家重点实验室彭孝军院士课题组。2022年进入河南大学基础医学院任教。研究方向:主要围绕菁染料光热免疫制剂的构建及其抗肿瘤机制,专注于恶性肿瘤新型诊疗技术的研发,在NIR-II光热免疫治疗、纳米药物靶向递送等领域取得系列创新成果。主持河南省自然科学基金1项、河南省高等学校重点科研项目1项、河南省博士后科研项目各1项,参与国家自然科学基金面上项目1项。以第一作者及通讯作者在Adv. Healthc. Mater, ACS Mater. Lett, ACS Appl. Bio Mater, Nano Select等期刊发表研究论文6篇。
该研究得到河南省自然科学基金(242300421605)、河南省高等学校重点科研项目(24A530001)等资金支持。
全文链接:https://doi.org/10.1002/adhm.202504391