一、基础医学院郑善清教授团队在饮食限制和衰老领域研究取得重要进展
近期,河南大学黄河学者郑善清教授团队在衰老领域顶级期刊《Aging Cell》 (一区Top) 发表最新研究成果。该研究表明,交替日禁食(Alternative Day Fasting, ADF)可以通过增强溶酶体功能来延长秀丽隐杆线虫(Caenorhabditis elegans)的寿命。这项研究揭示了半胱氨酸蛋白酶B(Cathepsin B)在此过程中发挥的关键作用。
近年来,禁食对健康的益处引起了广泛关注。此前的研究表明,间歇性禁食可能有助于改善代谢健康、减少炎症并延缓衰老。然而,ADF是否能有效延长寿命,以及其作用机制仍然是研究人员关注的课题。
研究团队通过实验发现,在交替日禁食条件下,秀丽隐杆线虫的寿命显著延长。进一步的基因分析表明,ADF促进了半胱氨酸蛋白酶B(cpr-2和cpr-5基因)的表达,而这些基因的激活对维持溶酶体的稳定性至关重要。溶酶体是细胞内的重要降解和循环利用系统,其完整性关系到细胞健康和衰老进程。在ADF条件下,Cathepsin B蛋白的增加有效减少了溶酶体损伤,延缓了衰老过程。值得注意的是,该研究发现ADF对寿命的延长作用与饮食类型有关。当秀丽隐杆线虫摄入动物性蛋白来源的食物时,ADF显著延长了其寿命;然而,摄入植物性蛋白来源的食物时,ADF并未产生类似的效果。这一发现表明,蛋白质来源可能影响ADF的生理效应。
研究还发现,ADF的启动时间对寿命延长的效果具有决定性作用。如果在生命早期开始ADF,可能会影响生长发育并造成损伤;但如果在中年阶段启动ADF,则能有效延长寿命。而在晚年阶段开始ADF,则未能观察到明显的益处。
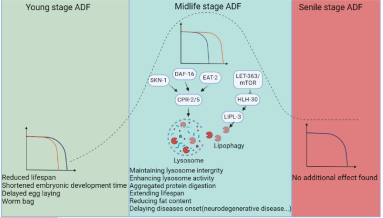
本研究揭示了半胱氨酸蛋白酶B在ADF延长寿命中的关键作用,为理解禁食的抗衰老机制提供了新的视角。未来,研究人员或将进一步探索该机制在人类和其他哺乳动物中的适用性。研究团队表示:“这项研究为优化饮食干预策略提供了重要依据,或许可以帮助人们在未来开发更精准的抗衰老方法。”
禁食作为一种健康干预手段,正受到越来越多的关注。这项研究为ADF的生物学基础提供了新证据,同时也揭示了蛋白质摄入类型对寿命影响的重要性。随着未来更多研究的深入,科学家或将进一步揭示禁食与长寿之间的奥秘,为人类健康长寿提供新的策略。
全文网址链接:DOI: 10.1111/acel.14286
作者信息: 河南大学基础医学院硕士研究生尹雪、代方舟为共同第一作者,河南大学曲直副教授、基础医学院郑善清教授为共同通讯作者。
此项研究获得河南大学高层次人才支持计划和中州实验室等多项基金资助。
二、基础医学院郑善清教授团队发表关于性别差异衰老调控机制研究的最新成果
近期,国际经典期刊《EMBO Reports》(一区Top) 发表了河南大学黄河学者郑善清教授团队的最新研究成果。该研究表明,雄性性别决定机制能够维持蛋白稳态,并延长daf-18/PTEN缺陷秀丽隐杆线虫(C. elegans)的寿命。该研究揭示了性别在衰老调控中的关键作用,为探索寿命延长机制提供了新的视角。
PTEN(phosphatase and tensin homolog)是一种关键的肿瘤抑制基因,在调节生长、代谢及衰老过程中起着重要作用。其线虫同源基因daf-18的缺失通常会导致寿命缩短。然而,该研究发现,在雄性秀丽隐杆线虫中,daf-18缺陷带来的负面影响被有效缓解,且雄性个体的寿命得到了延长。
研究人员通过实验发现,雄性线虫在daf-18缺陷条件下仍能维持蛋白稳态,而雌雄同体个体则表现出较高水平的错误折叠和聚集蛋白。这表明,雄性个体可能拥有一种独特的蛋白降解和稳态调控机制,使其能够抵御daf-18缺陷引发的细胞损伤。
进一步的分子机制分析表明,这种寿命延长效应与UNC-23/NEF介导的蛋白泛素化和降解过程密切相关。研究人员发现,雄性个体则能够通过UNC-23/NEF通路促进受损蛋白的降解,从而维持细胞功能的稳定。研究还表明,雄性决定机制不仅影响生殖相关特性,还可能对个体的衰老和寿命产生深远影响。研究人员指出,性别差异在衰老研究中往往被忽视,而该研究提供了有力证据,表明雄性个体可能具备独特的抗衰老能力。
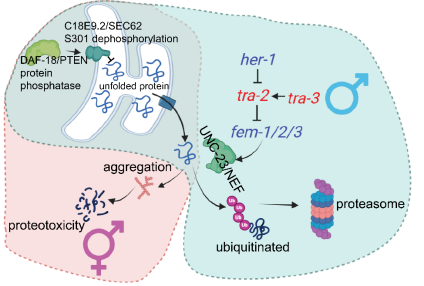
该研究的发现为性别与衰老机制的关联提供了新的线索。研究人员表示,未来将进一步探索PTEN调控性别决定通路的具体机制,以及该机制是否在人类衰老过程中也发挥类似作用。此外,该研究可能为性别特异性疾病的治疗提供新思路,例如神经退行性疾病中与蛋白稳态失调相关的病症。
雄性决定机制在维持蛋白稳态和延长寿命中的作用,为理解衰老提供了新的视角。该研究不仅有助于揭示性别与衰老之间的复杂关系,也为未来的抗衰老干预策略提供了潜在的研究方向。
全文网址链接:DOI: 10.1038/s44319-025-00368-x
作者信息: 河南大学曲直副教授和河南大学基础医学院硕士研究生张璐、尹雪为共同第一作者,河南大学基础医学院郑善清教授为通讯作者。
此项研究获得河南大学高层次人才支持计划和中州实验室等多项基金资。
三、基础医学院安杨副教授在《Cell Death and Disease》发表研究成果
近期,河南大学与萨斯喀彻温大学联合团队在《Cell Death and Disease》(一区Top)发表题为《Deciphering the interaction between Twist1 and PPARγ during adipocyte differentiation》的研究论文,揭示了转录因子Twist1通过直接抑制PPARγ的转录活性调控脂肪细胞分化的分子机制,为肥胖及相关代谢疾病的治疗提供了新思路。

肥胖的全球流行与脂肪组织过度增生密切相关,而脂肪细胞分化受核心转录因子PPARγ的级联调控。Twist1作为bHLH家族成员,此前已知在癌症转移和肌肉分化中发挥作用,但其在脂肪生成中的功能机制尚不明确。通过过表达Twist1的3T3-L1前脂肪细胞和C3H10T1/2间充质干细胞模型,研究发现Twist1显著减少脂滴积累,并降低PPARγ、脂联素(AdipoQ)等脂肪生成标志物的表达。染色质免疫沉淀(ChIP)和双荧光素酶报告基因实验证实,Twist1可直接结合PPARγ和脂联素基因启动子,抑制其转录。免疫共沉淀(Co-IP)与非变性电泳显示,Twist1与PPARγ及其异源二聚体伙伴RXRα直接结合,阻断PPARγ的DNA结合活性。RNA测序分析表明,Twist1过表达导致脂解和PPARγ信号通路相关基因显著下调,进一步支持其调控作用。
该研究首次系统阐明Twist1通过“双重机制”(抑制PPARγ转录及蛋白活性)负调控脂肪生成。鉴于Twist1在成熟脂肪细胞中的表达反弹,未来研究可探索其在不同分化阶段的动态功能。此外,靶向Twist1-PPARγ互作或为开发抗肥胖药物提供新方向。
全文网址链接:DOI: 10.1038/s41419-023-06283-0
作者信息: 河南大学基础医学院季少平教授团队已毕业硕士研究生孙磊磊为第一作者,河南大学基础医学院安杨副教授与萨斯喀彻温大学Jian Yang教授为共同通讯作者。