文案:李胜
胚胎干细胞(ESCs)对细胞因子或病原体均表现出减弱的炎症反应,这是胚胎干细胞的一个独特特征。这一特征对早期胚胎发育、组织损伤修复、以及再生医学应用等具有重要影响,但目前人们对胚胎干细胞维持低炎症反应能力的分子机制仍不清楚。
2024年2月21日,河南大学基础医学院陈苏教授课题组与山东第一医科大学科创中心孙锦教授课题组合作在Developmental Cell杂志在线发表了题为“ATG5 attenuates inflammatory signaling in mouse embryonic stem cells to control differentiation”的文章。该研究揭示了自噬相关蛋白ATG5通过非自噬途径抑制NF-kB炎症信号通路的分子机制,发现了一条全新的ATG5-β-TrCP1-NF-kB炎症相关信号轴,并且该调控轴对小鼠胚胎干细胞(mESCs)炎症反应以及分化的影响。

ATG5是自噬的关键调控因子,在自噬小体的成熟过程中发挥着重要作用。陈苏课题组长期致力于自噬蛋白的非自噬功能研究,在之前的研究中发现ATG5以一种“自噬非依赖”的方式调节c-Myc的降解,并可能影响mESC的分化(Sheng Li, et al.iScience, 2021)。为了深入研究ATG5在调节mESC分化中的作用和机制,研究人员通过在mESC中改变ATG5的表达水平,发现ATG5对mESC的分化至关重要,并且调控作用不依赖于自噬,即ATG5通过非自噬的方式影响mESC的分化过程。
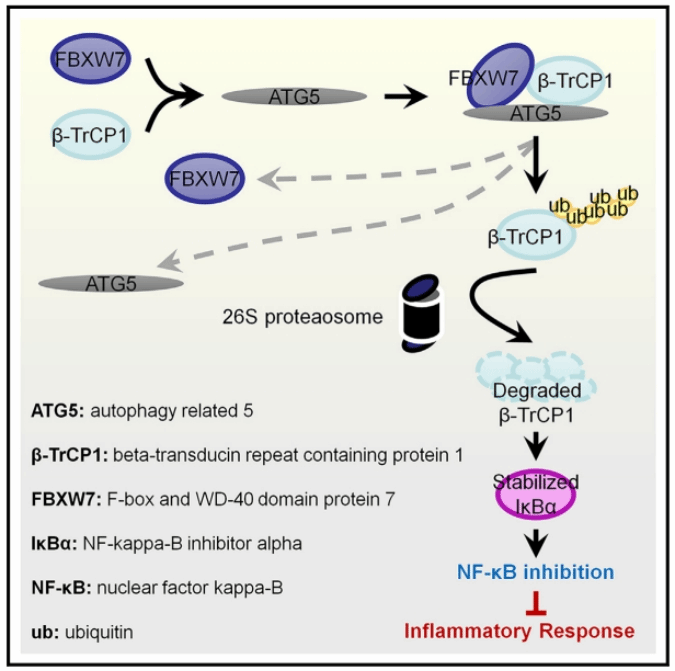
随后,为了全面了解ATG5调控mESC分化的分子机制,研究人员对ATG5缺失并诱导分化的小鼠胚胎干细胞进行了RNA-seq分析。通过GO分析发现,与对照组相比,在ATG5缺失并诱导分化的实验组中没有发现与分化相关基因的富集。但有趣的是,该实验组中炎症和免疫相关的基因出现显著上调。通过对NF-κB炎症信号通路标志蛋白的表达水平进行检测,发现ATG5的缺失显著上调NF-κB信号通路的活性,过表达IκBα超级阻遏物或施加NF-κB信号通路抑制剂PDTC能够很好地挽救由ATG5缺失引发的分化缺陷。另外,研究人员发现,ATG5可能作为一个支架蛋白,通过招募FBXW7与β-TrCP1结合,促进β-TrCP1的泛素化修饰并通过蛋白酶体途径被降解。为了检测ATG5-β-TrCP1调控轴是否影响mESC的分化,研究人员设计了拯救实验,发现在ATG5缺失的mESC中,进一步敲低β-TrCP1能够挽救其分化缺陷表型。此外,研究人员还进一步检测了ATG5-β-TrCP1调控轴对早期胚胎发育的影响,发现ATG5缺失的受精卵出现明显的发育缺陷,并且该发育缺陷可以通过进一步去除β-TrCP1得到挽救,这表明ATG5可能通过β-TrCP1影响早期胚胎发育。
总的来说,该研究揭示了mESC低炎症反应特性的一种可能分子机制,并且表明炎症与分化息息相关,为再生医学和胚胎发育相关疾病提供了重要的理论依据和药物作用靶点。
陈苏课题组博士研究生李胜、山东第一医科大学科创中心孙锦教授、陈苏课题组已毕业硕士研究生张博文、以及河南大学基础医学院青年教师杨璐为本文的共同第一作者,河南大学基础医学院席艳副教授和陈苏教授为通讯作者,陈苏为最后通讯作者(Lead Contact)。
论文链接:
https://www.cell.com/developmental-cell/abstract/S1534-5807(24)00046-7
上一条:基础医学院开展教学检查